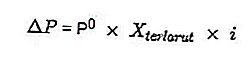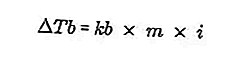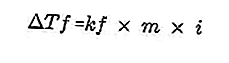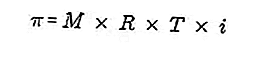Tentar prestar atenção ao que está ao nosso redor relacionado à química? O mais fácil é o ar que respiramos, que contém uma mistura de oxigênio, nitrogênio e outros gases. Temperos, corantes e conservantes alimentares também são outros exemplos de produtos químicos que estão ao nosso redor. Química é um ramo das ciências naturais que você vai estudar na escola que estuda vários materiais, um exemplo é a estrutura da matéria, propriedades da matéria, forma da matéria, mudanças na matéria, classificação da matéria, o arranjo da matéria e energia que acompanha essas mudanças. Não só a matemática e a física, a química também tem vários tipos de fórmulas, você sabe. Existem muitas fórmulas químicas com as quais você aprenderá, desde propriedades coligativas até reações redox.
Nesta ocasião aprenderemos diversas fórmulas químicas e também exemplos de problemas que o ajudarão a entender os conceitos de fórmulas químicas.
Fórmulas Químicas e Exemplos de Problemas
A presença de fórmulas na química serve para ajudar os pesquisadores a encontrar vários tipos de resultados experimentais a serem realizados. Para ser capaz de dominar bem esta ciência, você deve conhecer algumas fórmulas químicas que encontrará com frequência ao estudar química.
Fórmula para propriedades coligativas da solução
A natureza coligativa de uma solução é uma propriedade de uma solução que não depende de um tipo de substância solúvel, mas depende apenas da concentração das partículas da solução. Então, a natureza coligativa da solução consiste em dois tipos de propriedades, a saber, a natureza coligativa da solução eletrolítica e a natureza coligativa da solução não eletrolítica.
- Propriedades coligativas de soluções não eletrolíticas
Embora a natureza coligativa envolva uma solução, a natureza coligativa não depende da interação do soluto e das moléculas de soluto, mas com a quantidade de soluto dissolvido em uma solução. As propriedades coligativas consistem em uma diminuição na pressão de vapor, aumento no ponto de ebulição, diminuição no ponto de congelamento e pressão osmótica. Cada um requer uma fórmula química para obter o resultado.
- Equação de queda de pressão do vapor

Fonte: formula.co.id
- Equação de aumento do ponto de ebulição
O ponto de ebulição de um líquido é a temperatura fixa em que ele ferve. Nessa temperatura, a pressão de vapor do líquido tem uma equação na pressão do ar ao seu redor e é causada pela evaporação de todas as partes do líquido. O ponto de ebulição de um líquido pode ser medido por uma pressão de 1 atmosfera.
A diferença entre o ponto de ebulição de uma solução e o ponto de ebulição de um solvente puro é chamada de aumento do ponto de ebulição, a equação para o aumento do ponto de ebulição é:

Fonte: formula.co.id
- Equação de queda do ponto de congelamento
Um soluto presente na solução tornará o ponto de congelamento da solução menor do que o ponto de congelamento do solvente. Equação de redução do ponto de congelamento:

Fonte: formula.co.id
- Pressão osmótica
A pressão osmótica é uma força necessária para equilibrar a pressão do solvente da membrana semipermiável através da solução.
Uma membrana semipermeável é uma membrana através da qual as moléculas de solvente podem passar, mas os solutos não podem passar. De acordo com Van't Hoff, na pressão osmótica a solução é formulada da seguinte forma:

Fonte: formula.co.id
- Propriedades coligativas de soluções eletrolíticas
Na concentração, as propriedades coligativas de uma mesma solução eletrolítica têm um valor maior quando comparamos com as propriedades coligativas da solução não eletrolítica. Porque o grande número de partículas de soluto resulta da reação de ionização da solução eletrolítica que foi formulada no fator de Van't Hoff.
O cálculo das propriedades coligativas das soluções eletrolíticas será sempre multiplicado pelo fator de Van't Hoff da seguinte forma:

Fonte: formula.co.id
Algumas das fórmulas para as propriedades coligativas de outras soluções eletrolíticas são:
- Queda na pressão de vapor
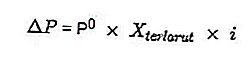
Fonte: formula.co.id
- Aumento do ponto de ebulição
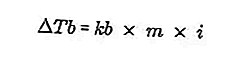
Fonte: formula.co.id
- Queda do ponto de congelamento
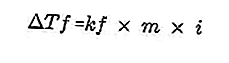
Fonte: formula.co.id
- Pressão osmótica
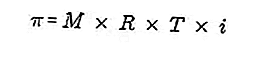
Fonte: formula.co.id
Fórmulas de molaridade, molalidade e fração molar
Molaridade (M)
Molaridade é o número de moles de uma substância dissolvida em 1 litro de solução.

Fonte: formula.co.id
M = molaridade
Mr = massa molar do soluto (g / mol)
V = volume de solução
Molalidade (m)
Molalidade é o número de moles da substância dissolvida em 1 kg de solvente. A fórmula química é a seguinte.

Fonte: formula.co.id
m = molalidade (mol / kg)
Mr = massa molar do soluto (g / mol)
massa = massa do soluto (g)
P = massa de solvente (g)
Fração mol
A fração molar é uma unidade de concentração em que todos os componentes da solução são calculados com base em moles.

Fonte: formula.co.id
xi = número de moles
i, j, xj = fração molar
Exemplos de problemas de fórmulas químicas
1. Se à pressão osmótica em 500 ml de solução de frutose, C6H12O6 de 32 ° C é 2 atm, a massa de frutose dissolvida é?
Solução:

2. Na fração molar da solução de ureia em água 0,2. A pressão do vapor saturado da água pura com temperatura de 20 ° C é de 17,5 mmHg. Então, na solução, a pressão de vapor saturado na seguinte temperatura é?
X uréia + X água = 1
0,2 + X água = 1
X água = 0,8
Solução P = X água x P água
P da solução = 0,8 x 17,5 mmHg
P da solução = 14 mmHg
Essas são algumas fórmulas químicas que você pode aprender para tornar mais fácil responder a vários tipos de questões de química. Se você acha que essas fórmulas não são suficientes, você pode experimentar o produto PROBLEM, uma solução de prática on-line completa e ponderada para a classe inteligente, como trigonometria, limite, logaritmo e muitos mais. Do ensino fundamental, médio ao ensino médio, com diversas disciplinas como matemática, física, química e outras. Aqui você pode aprender vários tipos de fórmulas completas com exemplos do problema.
Vamos, o que você está esperando! Vamos tentar os exercícios PROBLEM no Smart Class agora.