No artigo anterior, discutimos o que é uma reação redox. As reações redox comumente usadas nas áreas de farmácia, biologia, indústria, metalurgia e agricultura são tipos de reações de oxidação e redução que ocorrem simultaneamente. Durante uma reação redox, o número de elétrons perdidos é igual ao número de elétrons ganhos.
As reações redox consistem em reações de redução e oxidação. Redução é o processo de remover oxigênio ou um elemento eletronegativo de uma substância ou adicionar hidrogênio ou um elemento eletropositivo a uma substância. Enquanto isso, a oxidação é a adição de oxigênio ou qualquer elemento eletronegativo a uma substância ou a remoção de hidrogênio ou qualquer elemento eletropositivo de uma substância.
Existem vários tipos de reações redox com as quais estamos familiarizados, incluindo reações de combinação, decomposição, troca e desproporção.
Reação de Combinação
Reações combinadas são reações quando dois ou mais elementos se combinam para formar um único composto.
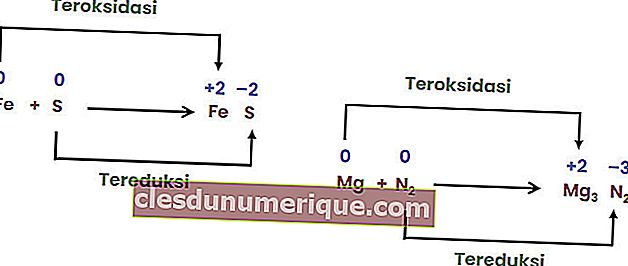
Reação de decomposição
Uma reação de decomposição ou decomposição é uma reação quando um composto se quebra ou se quebra em duas ou mais substâncias ou elementos simples. As reações de decomposição são comumente referidas como o oposto das reações combinadas.
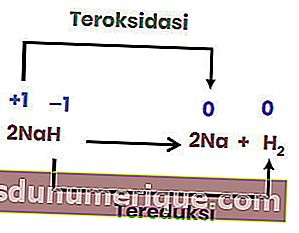
No entanto, nem todas as reações de decomposição são reações redox. Um exemplo é a seguinte reação.
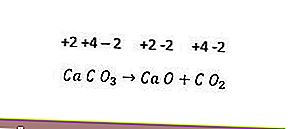
Como não há mudança no número de oxidação de cada elemento, a reação acima não é uma reação redox. Para que uma reação de decomposição seja uma reação redox, pelo menos um dos componentes que é formado deve estar na forma elementar.
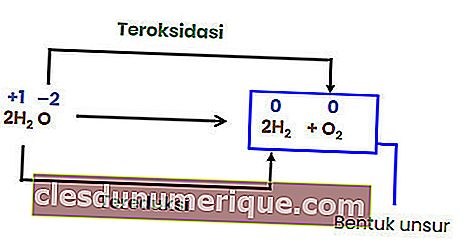
Reação de troca
Uma reação de troca ou substituição é uma reação em que átomos ou íons em um composto são substituídos por átomos ou íons de outro composto. As reações de substituição são classificadas em substituições metálicas e não metálicas.
(Leia também: Descubra sobre as reações redox)
A substituição de metal ocorre quando um metal em um composto é substituído por um metal que é mais reativo no estado livre. Um exemplo é a reação abaixo.

As reações de substituição de metal são úteis em processos metalúrgicos quando o metal puro é obtido a partir dos compostos presentes no minério.
Enquanto isso, as reações de substituição de metais não incluem a substituição de hidrogênio, halogênios e, às vezes, oxigênio. Todos os metais alcalinos e alguns metais alcalino-terrosos (Ca, Sr e Ba) substituem o hidrogênio da água fria. Um exemplo pode ser visto na seguinte reação.
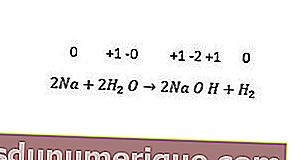
Reação de desproporção
O último tipo de reação redox é a desproporção. Essa reação ocorre quando o mesmo elemento é oxidado e reduzido simultaneamente. Elementos com três ou mais números de oxidação podem atuar como seus próprios agentes oxidantes e agentes redutores. Um exemplo é a seguinte reação.
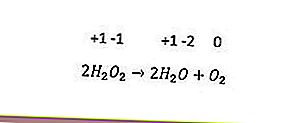
Na reação acima, o número de oxidação do oxigênio (-1) é reduzido para -2 e oxidado para 0.